 四川大学物理化学.ppt
四川大学物理化学.ppt
《四川大学物理化学.ppt》由会员分享,可在线阅读,更多相关《四川大学物理化学.ppt(39页珍藏版)》请在第壹文秘上搜索。
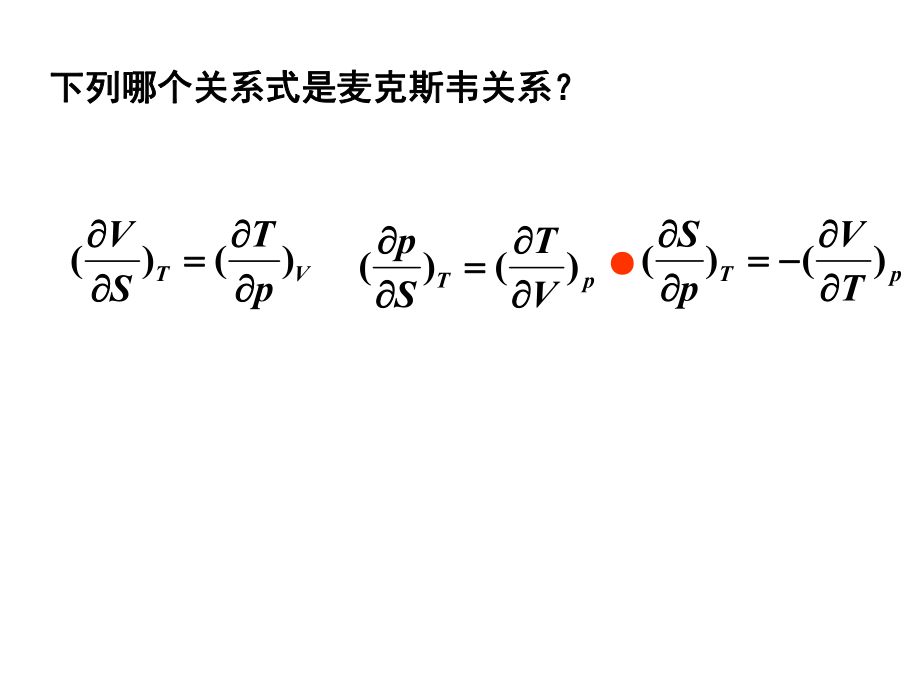
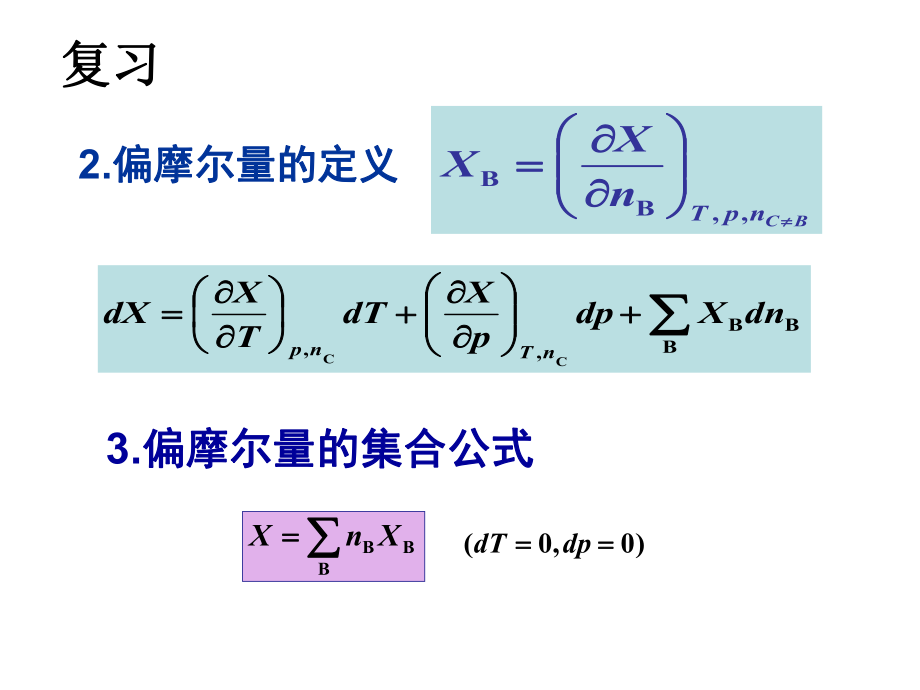
1、VSSpVT pSSVpT VTTpVS pTTVpS 1. Maxwell关系式关系式复习复习SVVSTp SppSTVTVVTSpTppTSV 倒置关系倒置关系VTpTSV)()( pTVTSp)()( pTTVpS)()( 下列哪个关系式是麦克斯韦关系?下列哪个关系式是麦克斯韦关系?BCnpTnXX ,BB2.偏摩尔量的定义偏摩尔量的定义 BBB,CCdnXdppXdTTXdXnTnp复习复习3.偏摩尔量的集合公式偏摩尔量的集合公式 BBBXnX)0, 0( dpdT4.Gibbs-Duhum公式公式BBB0 (00)x dXdTdp ,5.化学势的定义化学势的定义BC,BBB npTn
2、GG 化学势在判断相变化和化学变化的方化学势在判断相变化和化学变化的方向和限度方面有重要作用向和限度方面有重要作用BBBdnpdVTdSdU BBBdnVdpTdSdH BBBdASdTpdVdn BBBdnVdpSdTdG 6. 多组分单相系统热力学基本公式多组分单相系统热力学基本公式C BC BC BC BBBBBB, , ,T p nS V nS p nT V nGUHAnnnn )()(BBB dnVdpSdTdG )()(BBB dnpdVSdTdA )()(BBB dnVdpTdSdH )()(BBB dnpdVTdSdU 7.多组分多相系统热力学公式多组分多相系统热力学公式8.化
3、学势与温度、压力的关系化学势与温度、压力的关系CB,()p nBST CB,()T nBVp CB,2(/)Bp nTHTT 3. 化学势判据化学势判据(1)过程自发性的熵判据)过程自发性的熵判据(2)过程自发性的)过程自发性的Gibbs判据判据 恒温恒温,恒压下恒压下,系统内部发生相变化或系统内部发生相变化或化学变化时,化学变化时,)()(BBB dnVdpSdTdG )()(BBB等温,等压等温,等压 dndG )0, 0, 0(0)()(BBB WdpdTdn平衡平衡自发自发 )()(0,0,0 BBWdpdT )( )( )(B dn)()(BB dndn )()()()()()(BB
4、BBBBB dndndndG )()()()(BBBB dndn )()()(BBB dn )()(BB 0 dG物质从化学势较高的状态向化学势较物质从化学势较高的状态向化学势较低状态的变化是自发过程低状态的变化是自发过程应用到单组分系统的相变化应用到单组分系统的相变化4. 多组分系统组成的表示多组分系统组成的表示及物质的标准态及物质的标准态(1)多组分系统组成的表示)多组分系统组成的表示(a)物质)物质B的摩尔分数(的摩尔分数(mole fraction) BBBBnnx1BB x(b)物质)物质B的质量分数(的质量分数(weight fraction) BBBBmm 1BB (c)物质)物
5、质B的物质的量浓度(的物质的量浓度(molarity))mmol(3BB Vnc(d)物质)物质B的质量摩尔浓度(的质量摩尔浓度(molarity))kgmol(1ABB mnb5.物质的标准态物质的标准态气体物质的标准态气体物质的标准态标准压力下,具有理想气体行为的纯气体的状标准压力下,具有理想气体行为的纯气体的状态,这是一个假想态。态,这是一个假想态。液体、固体物质的标准态液体、固体物质的标准态标准压力下的纯液体或纯固体的状态。标准压力下的纯液体或纯固体的状态。kPa100 p相变过程自发性的化学势判据相变过程自发性的化学势判据BB( )( ) 由于化学势的重要性,无论对于理论研究由于化学
6、势的重要性,无论对于理论研究还是实际应用,都需要建立还是实际应用,都需要建立化学势的解析表化学势的解析表达式达式 平衡平衡自发自发 本节课正题本节课正题气体、液体、固体气体、液体、固体化学势的解析表达式化学势的解析表达式2-2 气体组分的化学势气体组分的化学势)(Bg 1.单组分理想气体单组分理想气体2.多组分理想气体多组分理想气体3.真实气体真实气体4.混合真实气体混合真实气体理想气体的化学势理想气体的化学势 (1).单组分理想气体的化学势单组分理想气体的化学势( , )( )lnpT pTRTp这是纯理想气体化学势的表达式,是这是纯理想气体化学势的表达式,是T,p的函数的函数(2).多组分
7、理想气体中各组分的化学势多组分理想气体中各组分的化学势BBBBBB( , ,)( )ln( )lnln( , )lnBBpT p yTRTppTRTRTypT pRTy (3).纯真实气体的化学势纯真实气体的化学势CH4H2COppVm 对于非理想气体的对于非理想气体的 pVm- -p 图图(1) pVm 等温线与等温线与气体的种类气体的种类有关;有关;(3) pVm等温线还与等温线还与温度温度有关;有关;(2) pVm 等温线与等温线与p 的压力有关;的压力有关;当当T TB : p 较低时,较低时,pVm RT 1) TB :波义尔温度波义尔温度当当T =TB时,时, 当当T TB 时,时
8、, pVm RTpT TBT TBT =TBpVm 并且压力较低时,并且压力较低时, pVm = RT pVm与与RT的关系反映了非理想气体的的关系反映了非理想气体的可压缩性,引入压缩因子来表示非理想气可压缩性,引入压缩因子来表示非理想气体可压缩性相对于理想气体的偏差体可压缩性相对于理想气体的偏差Z = pVm / RT理想气体理想气体 Z = 1非理想气体非理想气体 Z 1,表示非理想气体较难表示非理想气体较难压缩压缩 2) 临界参数临界参数 气体变成液体的过程称气体变成液体的过程称为为液化液化 液化与气体的种类、温液化与气体的种类、温度有关还与压力有关,并度有关还与压力有关,并非单纯降温或

- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 四川大学 物理化学
 第壹文秘所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
第壹文秘所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。


 重点工作绩效评估自评表.docx
重点工作绩效评估自评表.docx
 第三节硫和氮的氧化物1精品教育.ppt
第三节硫和氮的氧化物1精品教育.ppt
