 物理化学化学势.ppt
物理化学化学势.ppt
《物理化学化学势.ppt》由会员分享,可在线阅读,更多相关《物理化学化学势.ppt(53页珍藏版)》请在第壹文秘上搜索。
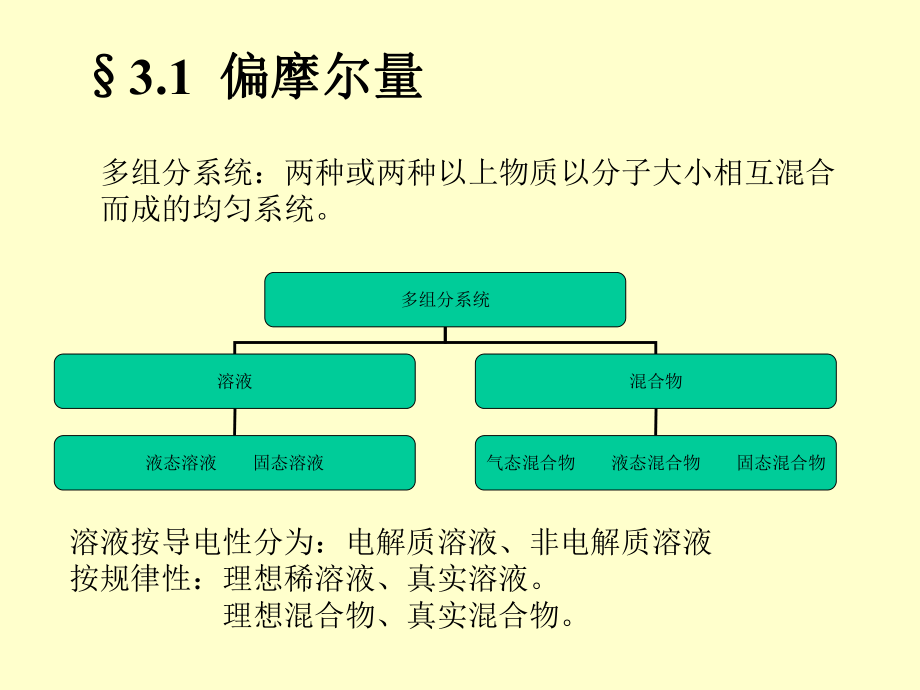
1、第三章第三章 化学势化学势 化学反应多在定温定压下进行,故吉布斯函数能够很方便地被用作反应方向和限度的判据。 多组分体系(例如:溶液、混合物)往往在常温常压下使用,因此吉布斯函数也是反映体系状态性质的一个重要的物理量。 综上,吉布斯函数 应用范围广。 故,在多组分体系中,任一组分的1mol物质的吉布斯函数,称为化学势。3.1 偏摩尔量偏摩尔量多组分系统:两种或两种以上物质以分子大小相互混合而成的均匀系统。多组分系统溶液混合物液态溶液固态溶液气态混合物液态混合物固态混合物溶液按导电性分为:电解质溶液、非电解质溶液按规律性:理想稀溶液、真实溶液。理想混合物、真实混合物。我们知道,对纯物质来讲,系统
2、的广度性质具有严格的加和性。 例. 20, 101kPa, 1mol水的体积 V*m水 = 18.09cm3/mol, 5mol水 V总=5molV*m水 = 90.45cm3 V*m水可理解成每mol水在20、1个大气压力下对纯物质单相系统(5mol水)的体积所作出贡献。(1)偏摩尔量的定义对多组分系统,是否也具有加和性呢? 5mol水 V水= 18.095 cm3 = 90.45 cm3 5mol乙醇 V乙= V*m,C5mol = 58.35 cm3/ mol5mol = 291.75 cm3二者简单相加得 V= (90.45+291.75)cm3 = 382.2cm3对混合液体实测发现
3、 V实测= 372cm3V= -10.2 cm3原因是水和乙醇的分子结构大小不同以及分子之间的相互作用定义: 多组分系统的任一种容量性质 X(X 可分别代表V,U,H,S,A,G 等),可以看作是温度T、压力p及各物质的量 nB, nC,的函数, X = (T,p,nB,nC,nD,) 当系统的状态发生任意无限小量的变化时,全微分dX 可用下式表示C,CDB,dnnXnnpTB,B,DC,CBCBdnnXdppXdTTXdXnnpTnnTnnp在定温定压条件下,dT=0,dp=0,并令则,dX = XBdnB ,其中 XB 称为物质B的 “偏摩尔量偏摩尔量” BC,BBnpTnXX偏摩尔量的物
4、理意义: 在定温定压条件下,往无限大的系统中(可以看作其浓度不变)加入1mol物质B所引起的系统某个热力学量X的变化。 偏摩尔量除与T、P有关以外,还与系统的浓度有关。在温度和压力不变的条件下,系统的浓度不同,则各物质的偏摩尔量也就不同。注意:注意:1. 只有广度性质才有偏摩尔量,强度性质不存在偏摩尔量;2. 只有在恒温恒压恒温恒压下,系统的广度量随某一组分的物质的量的变化率才能称为(该组分的)偏摩尔量。任何其它条件下的变化率均不称为偏摩尔量。3. 偏摩尔量和摩尔量一样,也是强度量。4. 对纯物质,偏摩尔量即为摩尔量。(2)偏摩尔量的集合公式 设系统由A和B组成,在定温定压下向系统中加入dnA
5、和dnB的A和B时,系统的某个容量性质 X 的变化可表示为 dX = XAdnA + XBdnB 若连续按比例dnA:dnB = nA:nB 加入,即保持系统浓度不变,则 即 X = XAnA + XBnB 上式称为两组分系统偏摩尔量的集合公式。 ABAABB000XnndXXdnXdn 当系统不只有两种组分、而是由k种组分组成时,同理可得 称为多组分均相系统中偏摩尔量的集合公式。 BBBCCAAXnXnXnX 3.2 化学势化学势(1)化学势的定义 在所有偏摩尔量中,偏摩尔吉布斯函数最重要。偏摩尔吉布斯函数GB 称为“化学势”,用符号B表示: 对多组分系统 BC,BBBnpTnGGBB,B,
6、BCdnnGdppGdTTGdGnpTnTnp 因为 故 由上一章知,在定温定压下,有 (d G) T,p W W为其它功。B,B,BC;npTnTnpnGVpGSTGBBdGSdTVdpdn 在恒温恒压下,若W = 0 (无其它功),则 不等号时表示始态到终态的过程是不可逆过程,能自动发生;等号时表示始态与终态达到平衡、可逆。 可见,物质的化学势是决定物质传递方向和限度的强度因素。 即, 若未来状态的G与现状态的G之差dG 0,则现状态将向未来状态发生转变,随之体系G值降低; 当dG = 0时, 现状态已是平衡状态,体系已处于最小的G值。BBBB0()= 0()dndn能能自自发发进进行行的
7、的过过程程平平衡衡(2)化学势在多相平衡中的应用 在定温定压及W= 0 时,若系统达平衡,则 dG = 0,即 现在讨论一个由 和 两个相 组成的系统 BB0dn 若有dnB的B物质从相转移入相,则相和相的吉布斯函数变化分别为 dG()= B() dnB dG()= B() dnB 总吉布斯函数变化为 dG = dG()+ dG() = B()B() dnB 当系统达成平衡时,dG = 0,因此必须 B() = B() 这就是说,多组分系统多相平衡的条件为:“除系统中各相的温度和压力必须相同以外,各物质在各相中的化学势亦必须相等”。即 B() = B() = B() 若化学势不相等,则该组分物
8、质必然要从化学势较大的相 向 化学势较小的相转移。 转移的结果使系统总G值(各相的G之和)降低。 (3)化学势在化学平衡中的应用以具体的化学反应 2SO2 + O2 = 2SO3为例,若O2有dn摩尔转化,则O2 减少了dn摩尔。因为是微小量变化,系统中各组分的化学势均未变化。 当反应达成平衡时,有 (dG)T, p = 0,则 如果 反应向左进行。,BB322B322()2 (SO )2 (SO )(O ) 2 (SO )2 (SO )(O )T pdGdndndndndn0)O()SO(2)SO(2223)O()SO(2)SO(2223 对任一化学反应3.3 气体物质的化学势气体物质的化学


- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 物理化学 化学势
 第壹文秘所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
第壹文秘所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。


 重点工作绩效评估自评表.docx
重点工作绩效评估自评表.docx
